
一种微流控类器官培养平台用于测试由NK细胞与生物制剂联合组成的免疫疗法。
Introduction
癌症治疗需要根据病人的具体情况制定个性化的治疗方案。患者衍生细胞系和患者衍生异种移植(PDX)模型是个体化癌症疗法选择的一些成熟方法,但存在以下缺点:
- 细胞系在培养过程中会随着时间的推移发生遗传和形态学变化;
- PDX模型的建立需要几个月的时间。
由于胰腺导管腺癌(PDAC)组织的高度纤维化和低细胞性,PDX模型的建立具有挑战性。 此外,PDAC是一种侵袭性癌症,65%的诊断发生在III期或以上,中位生存时间为8-10个月。建立PDX模型所需的时间往往接近生存时间,这意味着特定模型可能无法用于个性化治疗。
- 患者衍生癌症类器官(PDOs)有可能解决其他患者特异性癌症模型的局限性。PDOs是一种三维自组织结构,源自原代肿瘤细胞,具有与原生肿瘤相似的维度和拓扑结构。与其他癌症模型相比,PDOs的建立耗时少、成本低,因此可用于快速选择治疗侵袭性癌症的合适药物。
- 然而活检的细胞数量通常较少(≈100000-500000个细胞,具体数量取决于癌症类型和患者),这使得使用标准培养系统生成足够数量的类器官以测试疗法具有挑战性且耗时较长。 PDAC诊断与化疗之间的时间间隔≈4周,这意味着类器官的形成、扩增和疗法测试需要在这一时间范围内进行。
- 微流控细胞培养尤其适用于需要用有限数量的细胞进行多种药物测试的情况,如培养癌细胞和测试对治疗的反应。目前已有一系列研究进行了相关探索,但还没有关于从患者活检组织,特别是PDAC活检组织中提取微流控类器官培养物的报道。
在本研究中描述了从患者针刺活检组织中提取的PDAC类器官的微流控培养。如图1所示,设备包含微孔阵列(直径250 μm),这些微孔具有低粘附力,可促进细胞聚集成球。为了解决活检细胞数量极少的难题,该微流控设备包含一个用于直接注入类器官或类器官片段的端口。这一设计特点提高了类器官/组织的利用效率。研究表明,虽然微流控类器官在基因和表型表达方面与基于Matrigel的黄金标准类器官不相上下,但微流控培养具有多种优势,包括:
- 大小一致,便于评估化疗效果;
- 可添加NK细胞以创建免疫细胞-癌症类器官共培养物,研究癌症-免疫细胞的相互作用;
- 对Matrigel的依赖性最小。
此外,除了展示在新型装置中培养三种不同的PDO系外,作者还评估了新型疗法。这些疗法包括GSK抑制剂疗法(该疗法可使PDO对一线化疗(吉西他滨)产生敏感反应),以及由NK细胞和新型免疫调节生物疗法组成的癌症免疫疗法。研究强调了微流控类器官培养物在利用胰腺癌活组织切片的稀缺组织评估癌症治疗方面的效用,并代表着未来将这些培养物确立为辅助诊断的一个步骤。
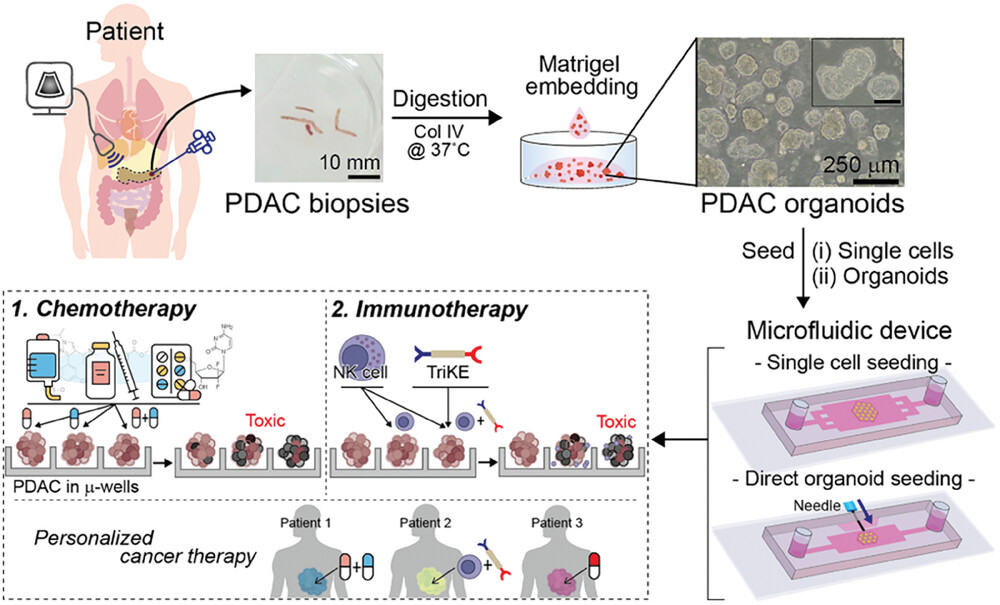
研究概念的示意图: 从患者身上采集活检组织,消化后培养成类器官,然后放入微流体设备中。本研究使用了两种微流控装置: 1)1 型装置用于单细胞接种;2)2 型装置用于完整的类器官或类器官片段播种。微流控类器官培养物被用来测试几种化疗药物以及由NK细胞和免疫调节分子TriKE组成的新型免疫疗法。
Comparing Microfluidic and Standard Organoid Cultures
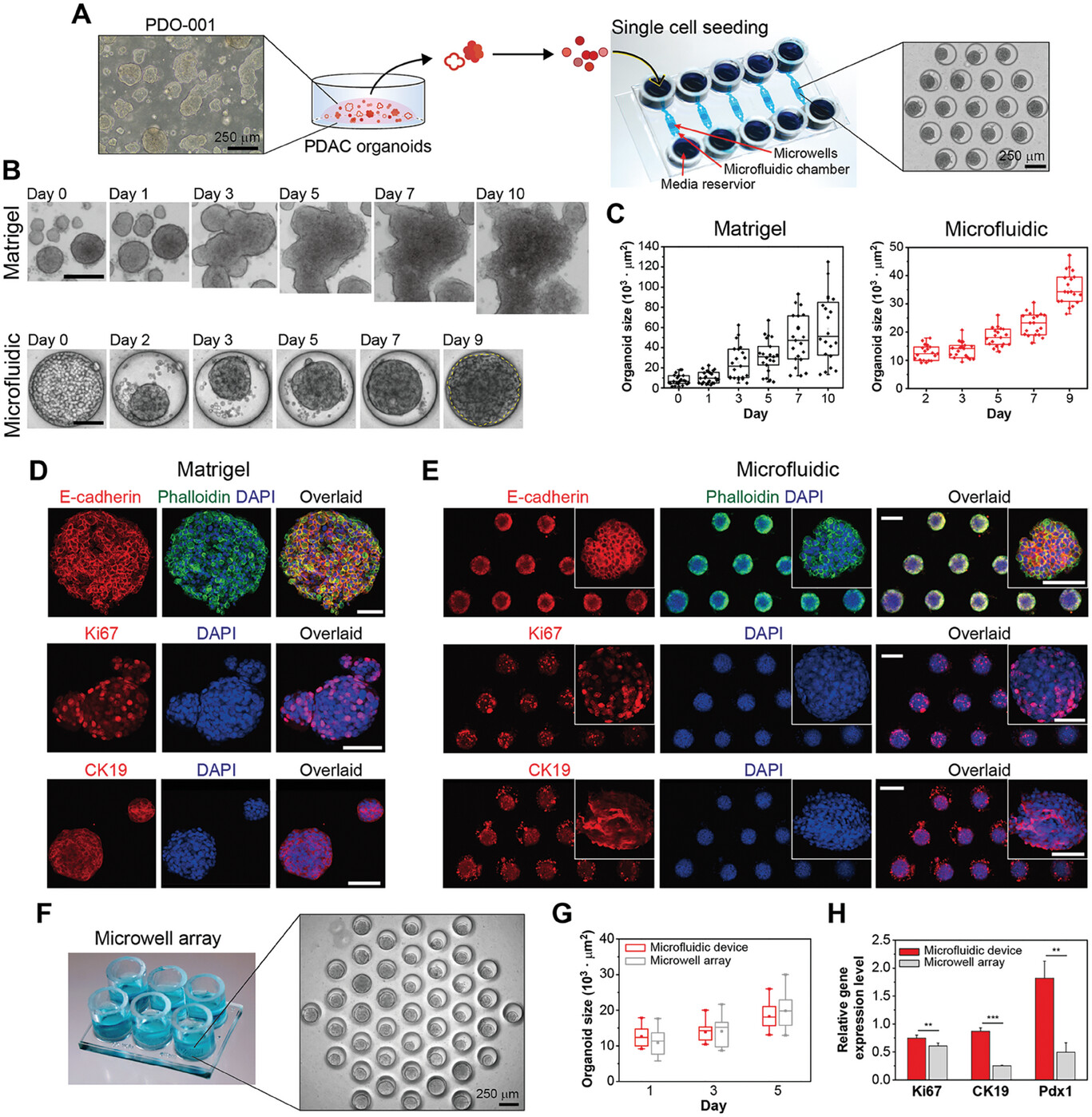
- (A)PDOs单细胞在微孔中接种的示意图。1型微流控装置用于从单细胞悬液中形成器官组织。插图显示微流控装置中的类器官(PDO-001)在接种5 d后的图像。
- (B)PDO-001在Matrigel(上图)和微流控装置(下图)培养过程中不同时间点的类器官图像
- (C)Matrigel和微流控装置中器官大小(面积)变化的量化。
- (D-E)在Matrigel(D)和微流控装置(E)培养的类器官中上皮(E-cadherin)、PDAC(CK19)和增殖(Ki67)标记物的免疫荧光染色。
- (F)微孔阵列培养格式—将克隆圆柱体安装在基于微孔阵列的PDMS上。插图显示培养5 d后的类器官(PDO-001)。
- (G)比较微孔阵列和微流控培养中的类器官生长。由于类器官合并,因此很难量化Matrigel培养物中的生长率。
- (H)比较不同培养方式的增殖标志物(Ki67)和癌症标志物(CK19和Pdx1)的基因表达。
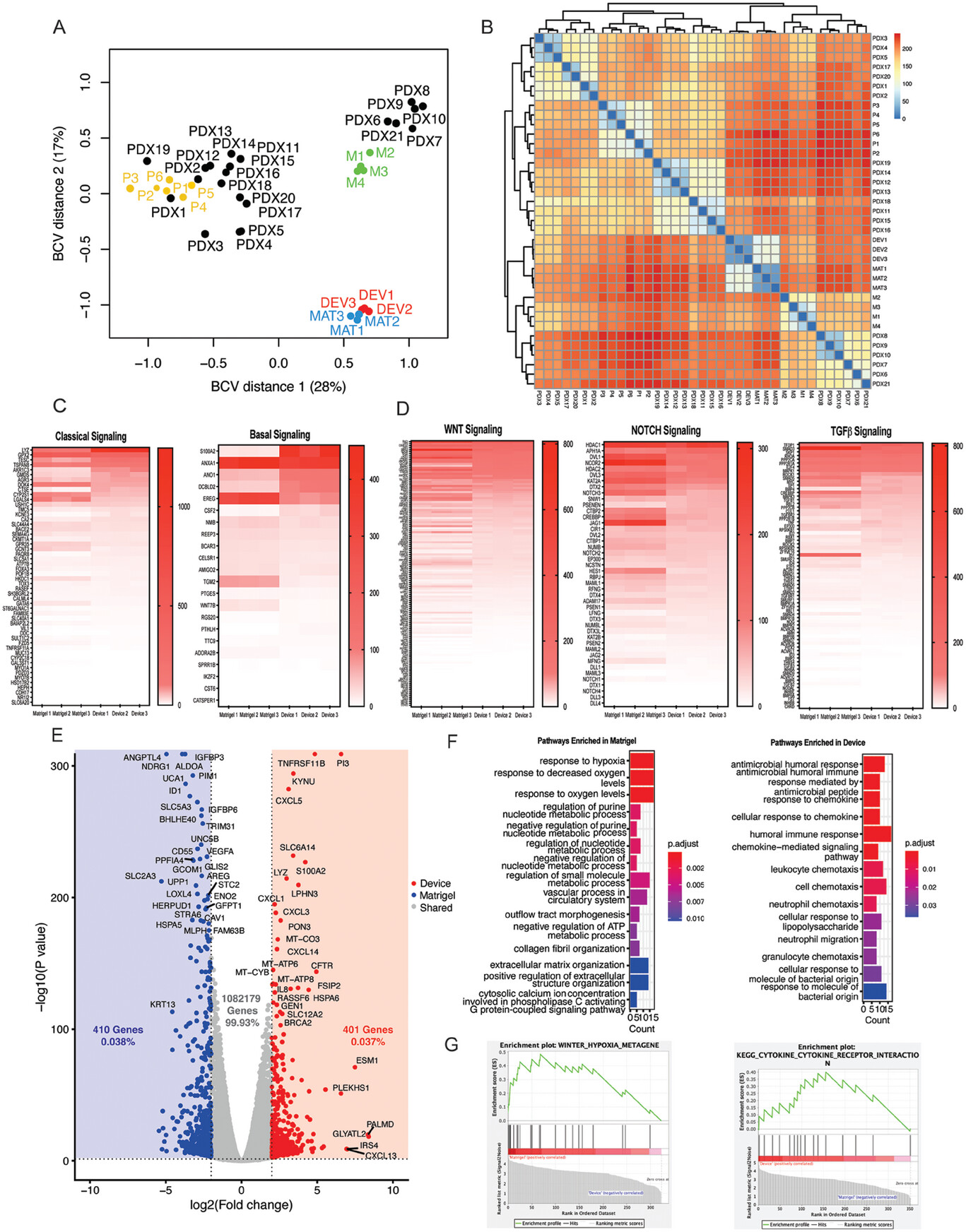
- (A)多维标度(Multidimensional scaling,MDS)图,比较微流控装置和Matrigel培养物中的PDOs,以及来自原发性 PDAC 肿瘤或 P、PDXs和转移瘤或 M的公开有机体测序数据。
- (B)微流控培养与Matrigel培养和与PDOs相比,通过皮尔逊相关性得出的样本间距离热图。表明装置和Matrigel类器官之间的相似度高于其他从原发肿瘤、PDX和转移瘤中产生的PDAC PDO样本。
- (C)在设备中培养的PDO与Matrigel中培养的PDAC的Basal和经典PDAC亚型标记物的归一化基因表达计数(每百万映射读数每千碱基读数或rpkm)热图。
- (D)WNT、NOTCH和TGF Beta信号通路的归一化基因表达计数(rpkm)热图。反映在已知参与类器官形成和维持的经典和基础胰腺癌信号传导和发育通路(WNT、NOTCH 和 TGF-β)的相似基因表达上,以及与预后较差的基底样亚型(如S100A2、ANO1和DCBLD2)相关的基因在微流控装置中上调。
- (E)与Matrigel培养相比,在设备中培养的PDO之间基因明显上调和下调的火山图突出显示。通过这一分析确定大多数基因(99.93%)在装置和Matrigel类器官培养物中表达相似,只有0.038%的基因在Matrigel中富集,0.037%的基因在微流控装置中富集。
- (F)在Matrigel培养和微流控培养差异表达基因中富集的生物过程基因本体。
- (G)选定的GSEA富集图,突出显示Matrigel和微流控培养平台中富集的关键通路。由此确定Matrigel类器官培养物富集了与缺氧相关的通路,这可能表明与微流控器官培养物相比氧合不足。Matrigel培养物还富集了细胞新陈代谢的变化,包括嘌呤合成和ATP生物合成的调节。这些变化可能表明,由于Matrigel中的类器官处于缺氧状态,无氧呼吸增加,可能对其长期存活率、表型和对治疗的反应产生负面影响。相比之下,微流控有机体似乎富集了与改善微环境交流有关的通路。与Matrigel培养物相比,微流控装置的实际优势不仅限于基因表达,还包括:1)球形大小分布均匀;2)易于随时间跟踪单个类器官;3)能够与免疫细胞建立共培养。
Culturing Intact Organoids in a Microfluidic Device
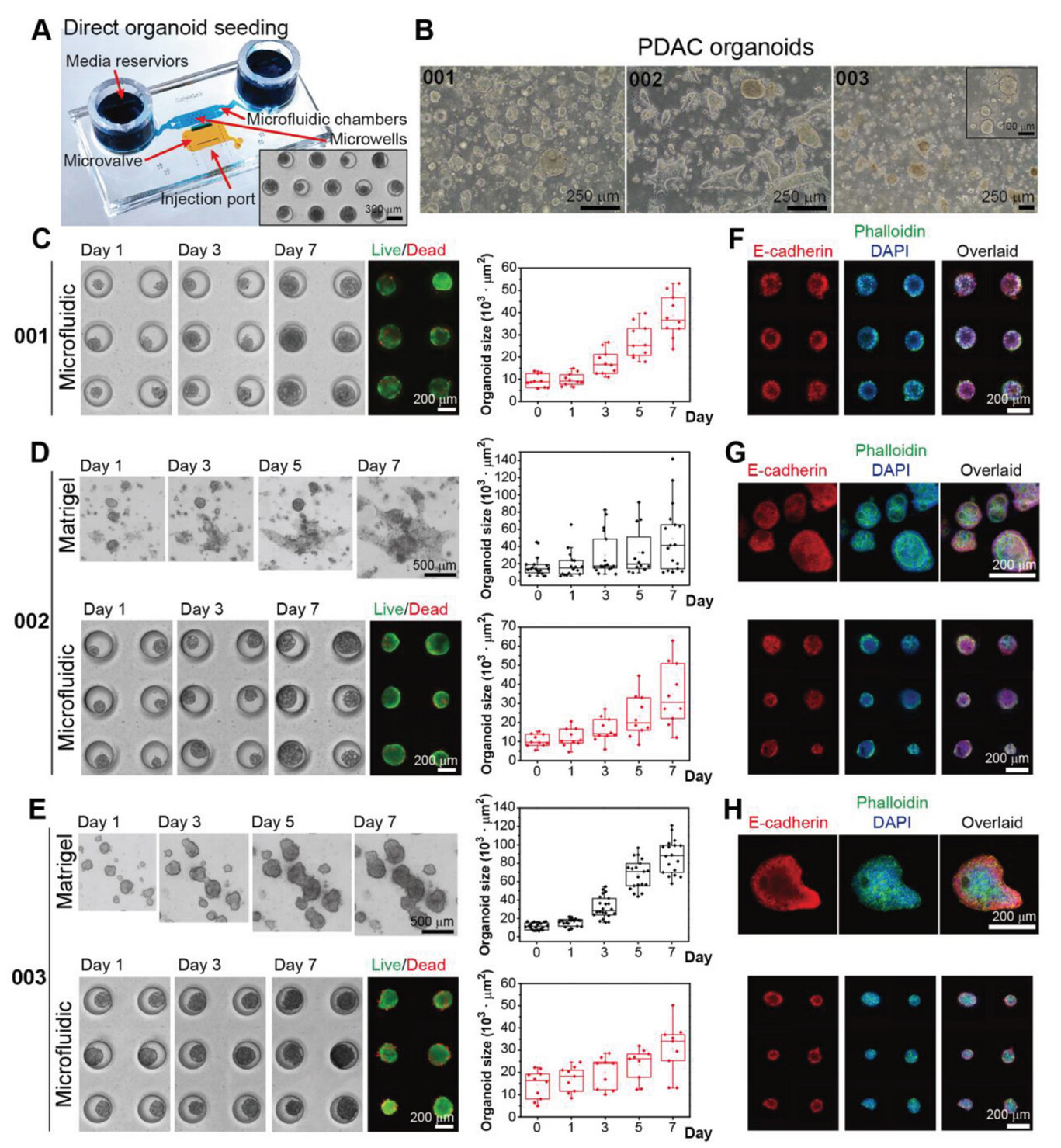
- (A)新型微流控装置带有注射口,用于将完整的类器官组织直接放入培养室。插图显示培养5 d后的完整类器官(PDO-001)。
- (B)Matrigel中来自三名不同患者的器官组织的代表性图像。可以看出,PDO在微流控装置中形成均匀的球体,但在Matrigel培养物中分布较为随机。事实上,没有观察到PDO-002形成独特的球体。不同的患者形态各异。PDO-001的类器官是紧凑、坚实的团块,边缘清晰,而PDO-003则是坚实的球形结构,随着时间的推移,类器官周围会堆积松散的细胞或碎屑。PDO-002的培养物在Matrigel中呈现出两种不同的形态:球形和拉长/伸展形。PDO-001和-002的一些类器官具有管腔结构,而PDO-003则没有观察到此类结构。
- (C-E)Matrigel和微流体培养物中类器官的时程图像。在第7 d对微流控类器官培养物进行活/死染色。微流控类器官培养物显示了在Matrigel中观察到的特征,PDO-001和-002显示了管腔/导管结构,而 PDO-003 则形成了紧凑的球体。
- (F-H)Matrigel和微流控装置中所有三个类器官系的E-cadherin(红色)免疫荧光染色。绿色和蓝色染色分别为肌动蛋白(类球蛋白)和细胞核(DAPI)。这些标记物的表达水平直观上与Matrigel中的类器官组织相当。
Assessing Interactions of PDMS-Based Microfluidic Devices with Chemotherapy Drugs
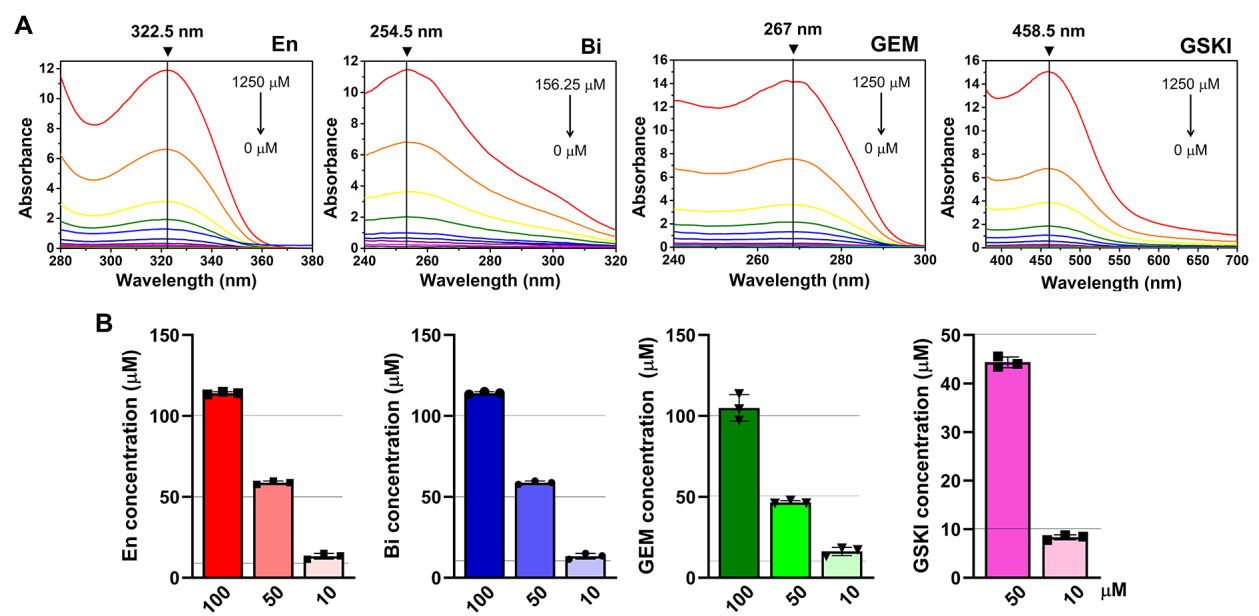
- (A)孔中PDAC对高浓度Bi和En+Bi组合处理的药物反应;
- (B)3种不同浓度的GEM。药物处理7 d后对活/死染色图像进行分析。
Testing Molecular Therapies Targeting RAF and MEK Kinases Using Microfluidic Organoid Cultures
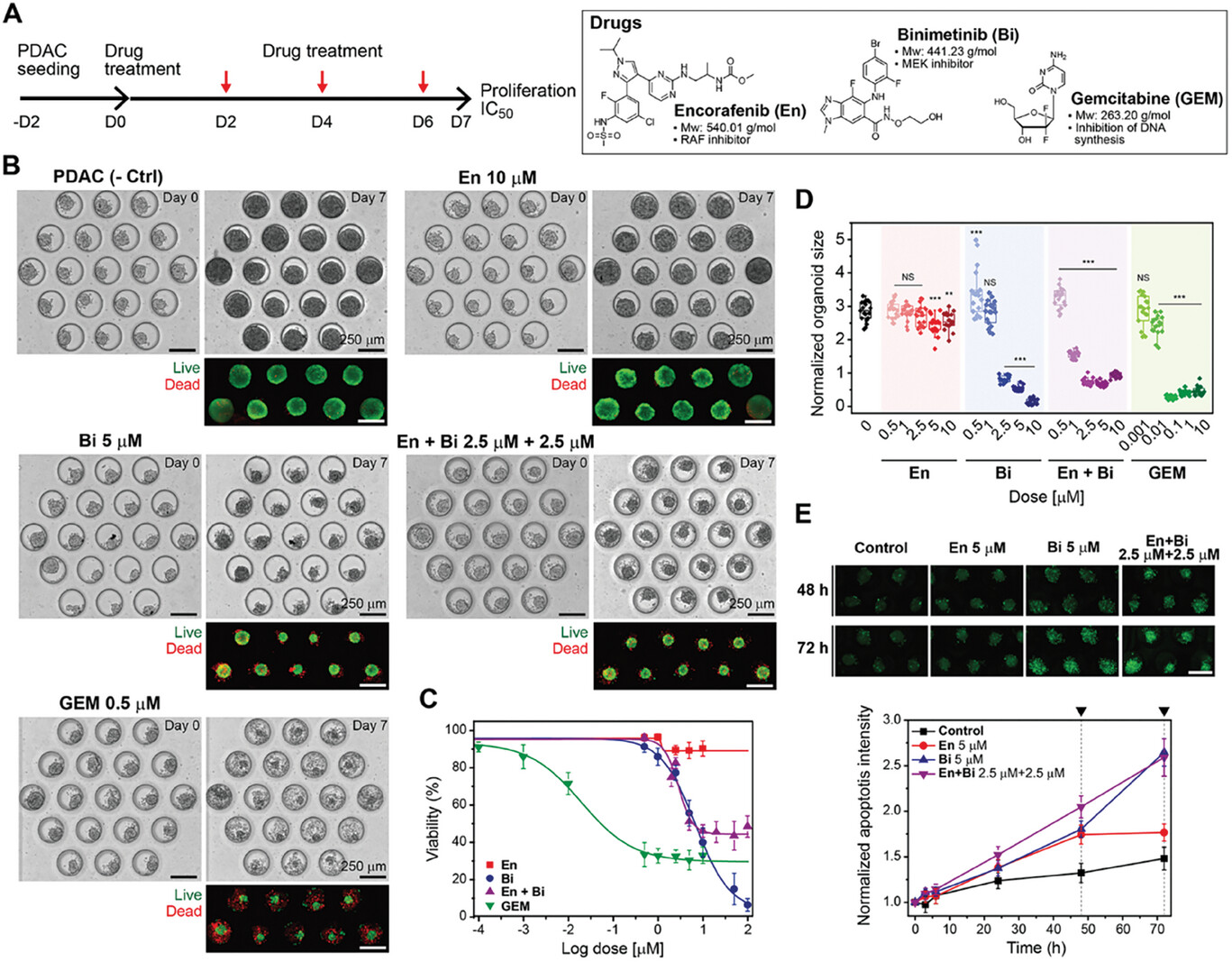
- (A)(左)细胞接种和给药的实验时间表。(右)本实验所用药物的化学结构: En、Bi(RAF和MEK抑制剂)和GEM。
- (B)第0 d和第7 d(治疗结束)各组微流控类器官培养物的代表性图像。荧光图像表示第7 d的活/死染色。虽然未经治疗的类器官在培养7 d后仍能增殖并保持较高的存活率(≈96%),但不同的治疗组和药物浓度会导致不同程度的癌症毒性。
- (C)四组药物治疗7 d后的相对药物反应图(存活率%)。
- (D)第7 d与第0 d相比,所有药物处理组的类器官大小变化。
- (E) 使用Caspase 3/7绿色检测法原位监测类器官组织的细胞凋亡。上图为48 h和72 h时的绿色荧光信号,下图为随时间变化的荧光平均强度。总的来说,与En相比,Bi是一种更有效的疗法,而且这些器官组织对GEM非常敏感。
Testing Efficacy of a Selective GSK-3β Inhibitor in Combination with GEM
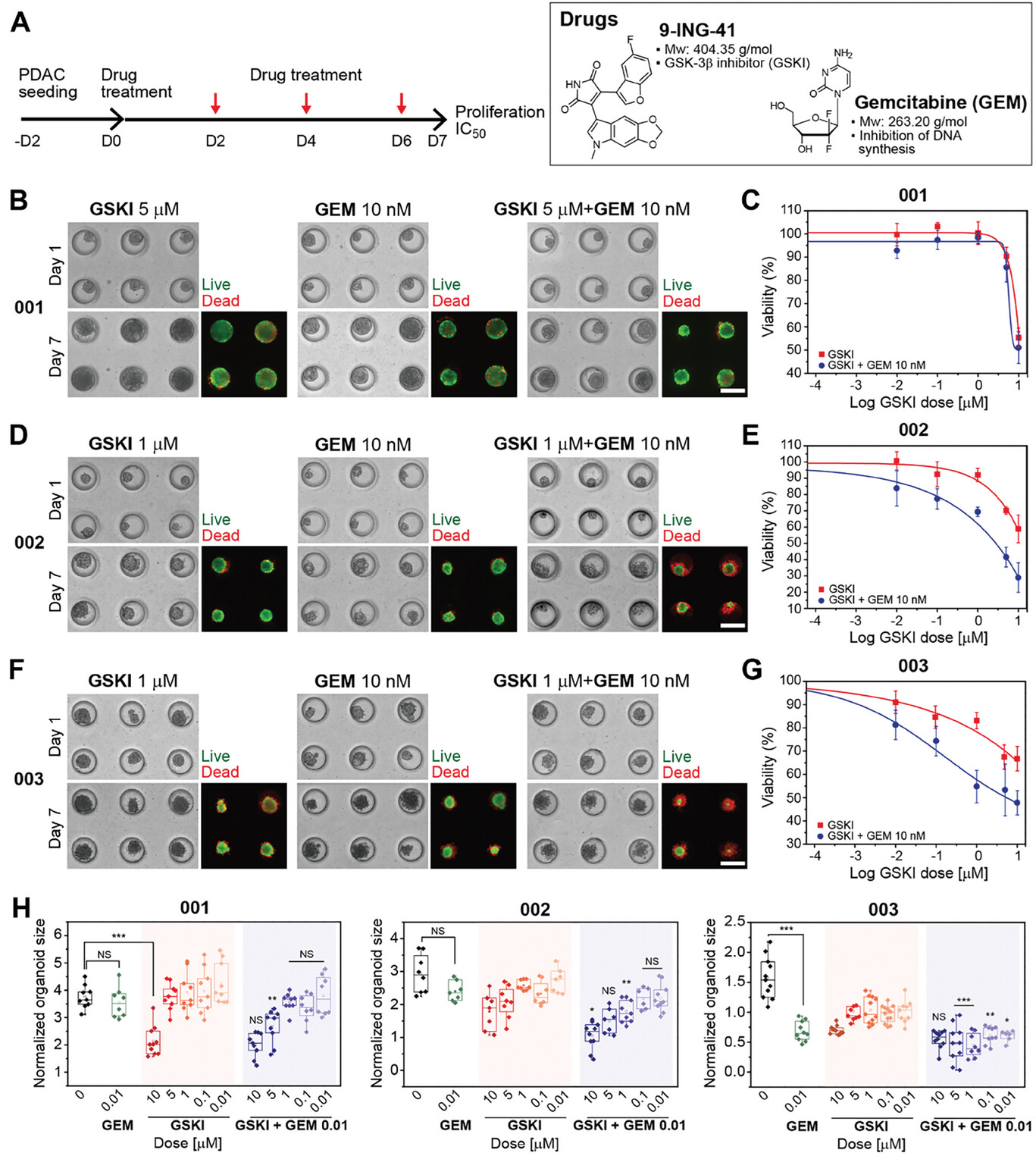
GSK-3β在PDAC中过表达,敲除或药物抑制GSK-3β会导致细胞增殖减少并诱导细胞凋亡。
- (A)(左)细胞播种和药物处理的实验时间表。(右)9-ING-41(GSKI)和GEM的化学结构和分子量。
- (B、D、F)用单个药物或药物组合处理 1 d或 7 d后的类器官图像。第7 d进行活/死染色以量化对治疗的反应。
- (C、E、G)根据第7 d的活/死染色量化单药(GSKI)和双药(GSKI+GEM)治疗的相对药物反应(存活率%)。
- (H)治疗后器官大小的相对变化。结果表明在所有浓度范围内,PDO-001的协同作用得分大于2.193,PDO-002的协同作用得分大于0.347,PDO-003的协同作用得分大于0.178。
Assessing Combination Cancer Immunotherapy of NK Cells and TriKE Immunomodulators Using Microfluidic Organoid Cultures
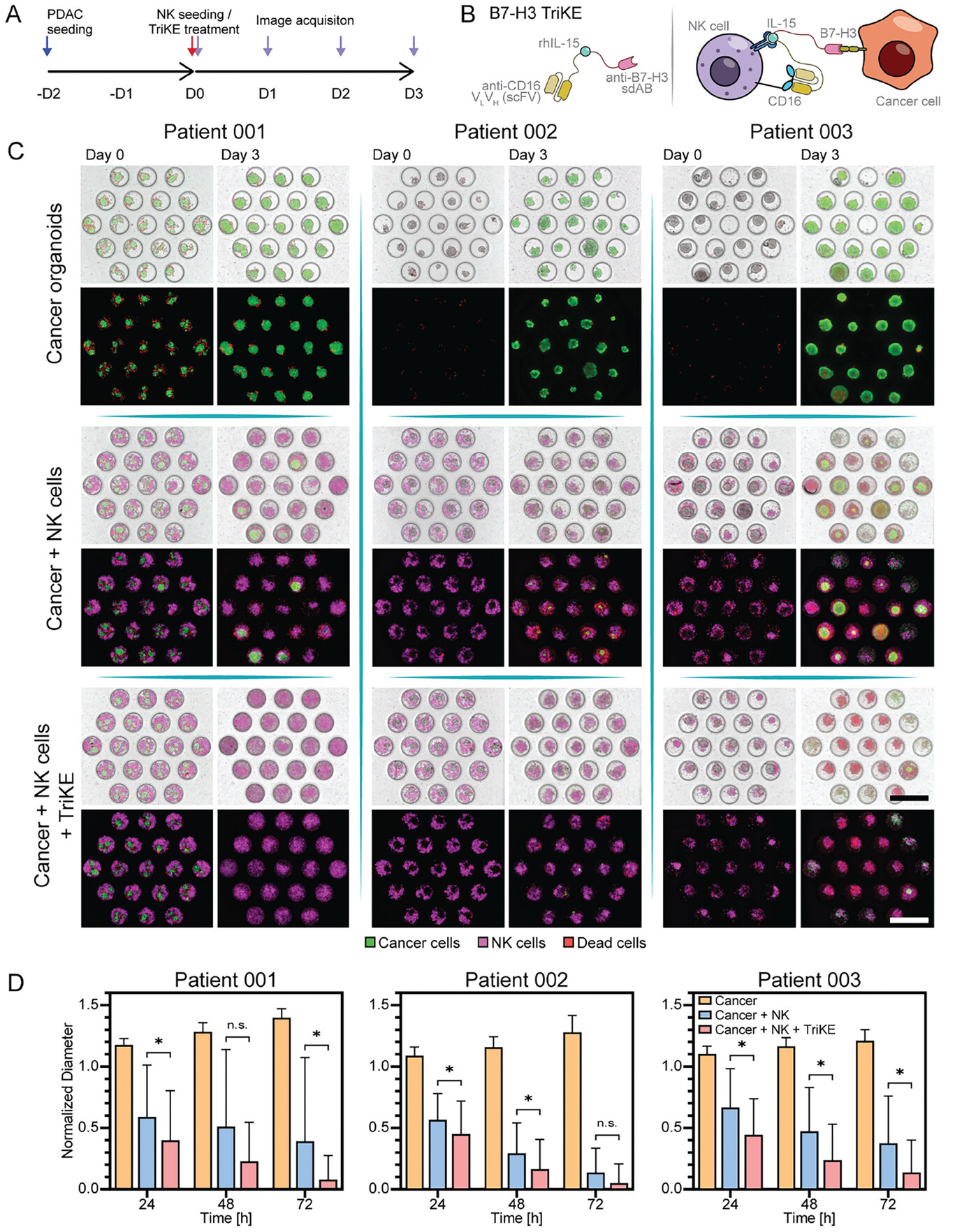
- (A)免疫疗法测试的时间表和工作流程。“D”表示每个步骤完成的日期。
- (B) 免疫调节剂B7-H3 TriKE的结构和功能示意图。该分子包含两个抗体片段:靶向NK细胞标记物的抗CD16和特异于癌细胞免疫检查点的抗B7-H3,以及刺激NK细胞的重组IL-15。
- (C)含有或不含NK细胞/B7-H3 TriKEs的微流控类器官培养物在培养第0 d和第3 d的代表性图像。
- (D)3 天治疗期间类器官直径的归一化变化。
Conclusion
在这项研究中开发并鉴定了新型PDAC类器官微流控培养物。证明微流控装置在类器官增殖、癌症表型表达以及免疫细胞的激活和浸润方面优于微孔阵列形式。RNA测序分析表明,微流控有机体培养物与黄金标准的Matrigel培养物相似,主要区别在于微流控培养物具有更好的供氧、趋化因子信号转导和免疫细胞浸润。与Matrigel培养物相比,微流控类器官在治疗测试方面更具优势,因为:
- 大小一致的有机体易于长期监测,以评估对治疗的反应;
- 能够引入免疫细胞以测试免疫疗法;
- 对Matrigel的依赖性最小,以维持类器官;
- 微流控类器官对分子靶向治疗有准确的反应。
总之,作者描述了一种用于测试患者特异性反应的新型微流控类器官培养平台。该平台有助于以类似于金标准Matrigel培养物的方式维持癌症类器官,利用针刺活检获得的极少量类器官进行药物测试,非常适合测试免疫疗法。未来可能会与生物传感功能相结合,对单个器官组织进行定量评估,并可能开发成个性化癌症治疗的辅助诊断工具。
Reference
Choi D, Gonzalez-Suarez A M, Dumbrava M G, et al. Microfluidic Organoid Cultures Derived from Pancreatic Cancer Biopsies for Personalized Testing of Chemotherapy and Immunotherapy[J]. Advanced Science, 2024, 11(5): 2303088.



